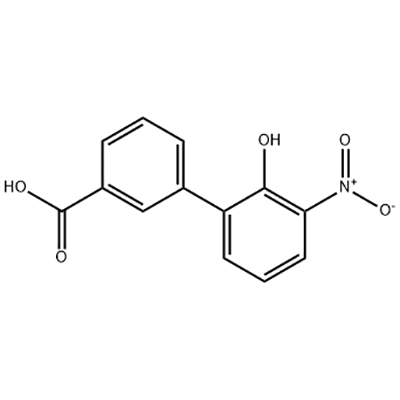
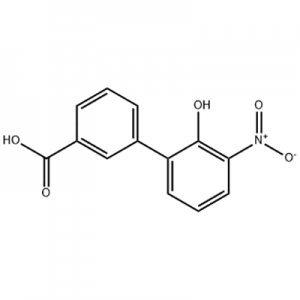
2'-hydroxy-3'-nitro-3-biphenylcarboxylsyre
2'-hydroxy-3'-nitro-3-biphenylcarboxylsyre
2'-hydroxy-3'-nitro-3-biphenylcarboxylsyre anvendes som mellemprodukt af Eltrombopag.
Eltrombopag, udviklet af GlaxoSmithKline (GSK) i Storbritannien og senere udviklet i fællesskab med Novartis i Schweiz, er den første og eneste godkendte lille molekyle ikke-peptid TPO-receptoragonist i verden.Eltrombopag blev godkendt af det amerikanske FDA i 2008 til behandling af idiopatisk trombocytopenisk purpura (ITP) og i 2014 til behandling af svær aplastisk anæmi (AA).Det er også det første lægemiddel godkendt af US FDA til behandling af AA i de seneste 30 år.
I december 2012 godkendte det amerikanske FDA Eltrombopag til behandling af trombocytopeni hos patienter med kronisk hepatitis C (CHC), således at hepatitis C-patienter med dårlig prognose på grund af lavt antal blodplader kan starte og opretholde interferonbaseret standardbehandling for leversygdomme.Den 3. februar 2014 meddelte GlaxoSmithKline, at FDA tildelte den banebrydende behandlingslægemiddelkvalifikation af Eltrombopag til behandling af hæmopeni hos patienter med svær kemikaliebog aplastisk anæmi (SAA), som ikke reagerede fuldt ud på immunterapi.Den 24. august 2015 godkendte det amerikanske FDA Eltrombopag til behandling af trombocytopeni hos voksne og børn i alderen 1 år og derover med kronisk immuntrombocytopeni (ITP), som har utilstrækkelig respons på kortikosteroider, immunglobuliner eller splenektomi.Den 4. januar 2018 blev Eltrombopag godkendt til at blive børsnoteret i Kina til behandling af primær immun trombocytopeni (ITP).


![Casp-unginacetat;Caspofunginacetat;Cancidas;Caspofunginacetat [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)


![2-butyl-5-nitro-3-benzofuranyl)[4-[3-(dibutylamino)propoxy]phenyl]](http://cdn.globalso.com/jindunchem-med/922e79ba.jpg)
